NOTICIAS
IMPLEMENTATION ROLLING PLAN Regulation (EU) 2017/745 and Regulation (EU) 2017/746. Update dec 2020
IMPLEMENTATION ROLLING PLAN Regulation (EU) 2017/745 and Regulation (EU) 2017/746. Update dec 2020 This rolling plan contains a list of identified essential implementing acts and other relevant initiatives that the Commission has adopted or intends to adopt in...
Register medical devices to place on the market
How to register your medical devices with the Medicines and Healthcare products Regulatory Agency (MHRA) for the markets in Great Britain and Northern Ireland The following devices in Great Britain (England, Wales and Scotland) need to be registered with...
14ª Edição da formação sobre as BPD: “Uma revisão abrangente da temática ,que combina a legislação com casos práticos”
Decorreu nos dias 2 e 3 de dezembro a 14ª edição do curso sobre as BOAS PRÁTICAS de DISTRIBUIÇÃO de medicamentos de uso humano e de substâncias ativas, conduzido pela reconhecida especialista Dra Sónia Rei. A Formação permitiu a todos os formandos ter acesso á...
Joint strategy sets direction for EMA and EU medicines regulatory agencies to 2025
News 08/12/2020 Publised by EMA EMA and the Heads of Medicines Agencies (HMA) have published their joint strategy for the next five years, following its recent adoption by the HMA and EMA Management Board. The strategy details how the European medicines regulatory...
Register as a manufacturer to sell medical devices from 1 January 2021
Published 7 December 2020 Last updated 7 December 2020 — see all updates From: Medicines and Healthcare products Regulatory Agency How to register your medical devices with the Medicines and Healthcare products Regulatory Agency (MHRA) for the markets in Great...
Affordable, accessible and safe medicines for all: the Commission presents a Pharmaceutical Strategy for Europe
PUBLISEH in https://ec.europa.eu/commission/presscorner/detail/en/ip_20_2173 The Commission has today adopted a Pharmaceutical Strategy for Europe to ensure patients have access to innovative and affordable medicines and to support the competitiveness,...
13ª EDIÇÃO da formação sobre as BPD : “Evento muito enriquecedor , ministrado por uma excelente profissional e técnicamente muito preparada”
Reconheciendo a relevância do cumprimento das Boas Práticas de Distribuição na indústria farmacêutica, a Formiventos organizou a edição número 13 do Curso : BOAS PRÁTICAS de DISTRIBUIÇÃO de medicamentos de uso humano e de substâncias ativas, conduzido pela...
New technical guidance on cosmetic hand gels addresses antibacterial and antiviral claims
Published on: 25/11/2020. www.ec.europa.eu The European Commission has issued a new technical document agreed by national authorities and stakeholders that further clarifies which claims producers of cosmetic products cannot make regarding their products. It adds to...
Boas Práticas de Fabrico : Uma formação foi muito interessante
Teve lugar no dia 24 de novembro a 3ª edição da formação sobre as BOAS PRÁTICAS DE FABRICO,conduzida pelo especialista Dr André Luz, da OWLPHARMA Nesta formação forneceu um análise detalhada das novas regulamentações , e foram abordados assuntos como : Novos...
Proposal on European data governance
REGULATION OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL on European data governance (Data Governance Act) This explanatory memorandum accompanies the proposal for a Regulation of the European Parliament and of the Council on data governance. It is the first of...
EUDAMED ACTOR MODULE FAQs
ACTOR MODULE FAQs November 2020 v1.0 Table of Contents 1. Countries available in EUDAMED from December 2020 2. Actor registration process 3. SRN 4. Actor roles 5. EUDAMED users 6. Support 7. Data Exchange
Contract Manufacturing Databook
SOURCE : INDUSTRY STANDAR RESEARCH . ISR Reports . www.isrreports.com It can be difficult to find industry-specific, easy-to-interpret, trustworthy market data. This e-book is full of free drug development and manufacturing facts, figures, and expert perspectives...
CREDITAÇÃO DA OF PARA A FORMAÇÃO ” BOAS PRÁTICAS DE FARMACOVIGILÂNCIA “
A 5ª Edição do Seminário deActualização nas BOAS PRÁTICAS de FARMACOVIGILÂNCIA , conduzida por o Dr António Azevedo, do Infarmed, foi creditada pela Ordem dos Farmacêuticos com 1.4 CDP A formação decorrerá os dias 2 e 3 de fevereiro de 2021, com o objetivo de lhe...
ANATOMY OF A FAILURE TO LAUNCH
ANATOMY OF A FAILURE TO LAUNCH: A REVIEW OF BARRIERS TO GENERIC AND BIOSIMILAR MARKET ENTRY AND THE USE OF COMPETITION LAW AS A REMEDY The purpose of this whitepaper is to examine the evolution of specific barriers to generic and biosimilar market entry in the...
Guidance on Classification Rules for in vitro Diagnostic Medical Devices under Regulation (EU) 2017/746
This guidance, relating to the application of Regulation (EU) 2017/746 on in vitro diagnostic medical devices (IVDR) addresses the classification of in vitro diagnostic medical devices (IVDs) and provides clarifications on the classification rules as set out under...
AUDITORIAS e INSPEÇÃO em FARMACOVIGILÂNCIA: Formação fluida, clara e adequada aos aspetos práticos
Decorreu nos dias 27 e 28 de outubro de 2020, a 3ª edição do curso sobre as AUDITORIAS e INSPEÇÃO em FARMACOVIGILÂNCIA:; conduzido pelo Dr. António Azevedo,Inspetor da Direção de Inspeção e Licenciamentos do INFARMED A Formação teve como objetivo proporcionar aos...
Gestão de Alterações aos termos de AIM: formação foi muito proveitosa e relevante , com excelente integração dos casos práticos com a teoria
Teve lugar nos dias 28 e 29 de novembro a 3ª edição da formação exclusiva da Formiventos sobre a Gestão de Alterações aos termos de AIM conduzida pelo especialista Dr Pedro Fins Pereira,Gestor de PRM e PDC / MRP/DCP Procedure Manager, da Direção de Avaliação de...
GMP para CANÁBIS : “Formação muito elucidativa , completando sempre que necessário com casos práticos “
Decorreu nos dias 28 e 29 de outubro de 2020, a 2ª edição da formação sobre GMP para Canábis para fins medicinais, conduzida pelo especialista Dr. André Luz, QA Consultant & Auditor da Owlpharma Todos os participantes avaliaram a iniciatíva como muito proveitosa...
Implementation of the Veterinary Medicines Regulation (VMP-Reg) programme.
Published by the European Medicines Agency Veterinary Medicines Regulation HIGHLIGHTS The European Union create the newsletter for the Implementation of the Veterinary Medicines Regulation (VMP-Reg) Programme. The Regulation will become applicable in January 2022...
Infarmed lança novo Sistema de Informação para Dispositivos Médicos (SIDM)
PUBLICADO NO SITE INFARMED 30 out 2020 Hoje, dia 2 de novembro de 2020, o Infarmed apresenta o novo Sistema de Informação para Dispositivos Médicos (SIDM). Com o objetivo de garantir que os dispositivos médicos (DM) existentes no mercado nacional respeitam os...
Ongoing guidance development within MDCG Subgroups
NEWS FROM EU: Ongoing guidance development within MDCG Subgroups – October 2020*. A lot of guidances planned in 2021!!! Ongoing guidance development within MDCG Subgroups
Novo Sistema de Informação para Dispositivos Médicos (SIDM)
Publicado no site Infarmed ,19 out 2020 Circular Informativa N.º 164/CD/100.20.200 Data: 19/10/2020 Com o objetivo de garantir que os dispositivos médicos (DM) existentes no mercado nacional respeitam os requisitos regulamentares de qualidade, segurança e desempenho,...
Guide to Using EUDAMED
Guide to Using EUDAMED Actor registration module for economic operators Version 0.1 – September 2020 EUDAMED is the IT system developed by the European Commission to implement the EU medical devices regulations: Regulation 2017/745 on medical devices...
Últimas vagas para a formação “Gestão de Alterações aos termos de AIM”
Nos próximos dias 28 e 29 de outubro , terá lugar a 3ª edição da formação exclusiva da Formiventos sobre Gestão de Alterações aos termos de AIM , conduzida pelo Dr Pedro Fins Pereira, Gestor de PRM e PDC / MRP/DCP Procedure Managerna Direção de Avaliação de...
Vagas esgotadas para a formação sobre AUDITORIAS e INSPEÇÃO em FARMACOVIGILÂNCIA
Nos próximos dias 27 e 28 de outubro , terá lugar a 3ª edição da formação exclusiva da Formiventos sobre AUDITORIAS e INSPEÇÃO em FARMACOVIGILÂNCIA, conduzida pelo experiente especialista Dr. António Azevedo, Inspetor da Direção de Inspeção e Licenciamentos do...
EMA offers new Q&A on data monitoring committees
Published EMA : Posted 08 October 2020 | By Michael Mezher The European Medicines Agency (EMA) on Thursday released a new guideline offering nine questions and answers on issues related to the role of data monitoring committees (DMCs) in the conduct and management...
EMA moves to IRIS for scientific advice questions
Posted 07 October 2020 | By Kari Oakes The European Medicines Agency (EMA) is transitioning to an online platform for drug developers to use when requesting scientific advice. The change will become effective on 19 October for developers of both human and veterinary...
Informação para os titulares de autorização de introdução no mercado: atualização do estado de comercialização
PUBLICADO INFARMED 08 out 2020 Para: Titulares de AIM Para garantir a qualidade da informação disponibilizada aos cidadãos e aos profissionais de saúde, foi atualizada informação relativa ao estado de comercialização de cerca de 100 embalagens, a fim de que a mesma...
EMA Guideline : Quality of water for pharmaceutical use
The guideline has been updated to reflect changes in the European Pharmacopoeia including the revised monograph for Water for Injections allowing methods other than distillation for producing water of injectable quality. The guideline has also been updated to reflect...
Novas creditações para as próximas formações de Outubro e Novembro
As seguintes formações contam com a acreditação pela Ordem dos Farmacêuticos Boas Práticas de Distribuição de Medicamentos. 14ª Edição 2 e 3 de dezembro de 2020 1.4 CDP ( 00207/9/2020 ) Boas Práticas de Distribuição de Medicamentos.13ª Edição 24 e 25 de...
Now published: EN 17141:2020 Cleanrooms and associated controlled environments – biocontamination control
The new European standard EN 17141:2020 has been issued on 12 August 2020 and will replace the DIN EN ISO 14698 (Parts 1 and 2) of the year 2003, which no longer reflects the state of the art. EN 17141 is based on a quality risk management approach and defines the...
EMA Guideline on registry-based studies
published by EMA News 24/09/2020. EMA has published its draft Guideline on registry-based studies for a three-month public consultation today. The new draft guidance aims to optimise the use of registry-based studies as a source of real-world evidence. Patient...
As formações de outubro e novembro , já prontas para avançar, recebem os creditos da OF
Algunas das formações previstas para os próximos meses , recebem as creditações da Ordem dos Farmacêuticos. 00203/9/2020 1.4 CDP Boas Práticas de Distribuição de Dispositivos Médicos Lisboa , 11 e 12 de novembro de 2020 00204/9/2020 1.1 CDP GMP para Canábis para fins...
How incidents with medicines are managed in the EU – a ten-year analysis by EMA
published by EMA News 23/09/2020. The EU medicines network is supported by a robust regulatory framework with defined processes and clear responsibilities in place to handle public health incidents, according to a 10-year analysis of the European Union incident...
Regulating medical devices from 1 January 2021 for the UK medical devices market
Published 1 September 2020 From: Medicines and Healthcare products Regulatory Agency New rules for January 2021 The UK has left the EU, and the transition period after Brexit comes to an end this year. From 1 January 2021 the Medicines and Healthcare products...
Últimas vagas para a 6ª Edição da formação sobre Gestão de Reclamações, Devoluções, Falsificados e Recolhas de Mercado
Últimas vagas disponíveis para a 6ª Edição Gestão de Reclamações, Devoluções, Falsificados e Recolhas de Mercado, do próximo dias 27 de outubro , conduzido pela conceituada especialista Dra. Sónia Rei , da Hikma . Nesta iniciativa oferecemos uma formação para...
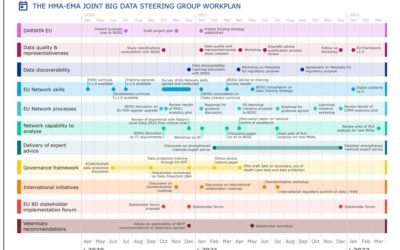
Making best use of big data for public health: publication of the Big Data Steering Group workplan for 2020-21
PUBLISHED BY EMA. EMA EUROPE News 14/09/2020 The Big Data Steering Group set up by EMA and the Heads of Medicines Agencies (HMA) has published its workplan which sets actions to be delivered in 2020-21. With the European Medicines Regulatory Network focused on...
Guidelines 07/2020 on the concepts of controller and processor in the GDPR
Guidelines 07/2020 on the concepts of controller and processor in the GDPR Version 1.0 Adopted on 02 September 2020 This document seeks to provide guidance on the concepts of controller and processor based on the GDPR’s rules on definitions in Article 4...
NOVAS DATAS para a formação sobre as BOAS PRÁTICAS DE DISTRIBUIÇÃO DE MEDICAMENTOS E DISPOSITIVOS MÉDICOS
Dada a elevada procura , abrimos novas datas para as formações sobre: Gestão de Reclamações, Devoluções, Falsificados e Recolhas de Mercado Lisboa, 27 de outubro de 2020 Boas Práticas de Distribuição de Dispositivos Médicos Lisboa , 11 e 12 de novembro de 2020...
FDA NEW GUIDANCE : “Biological evaluation of medical devices
The scope of this document and accompanying attachments is limited to the biological evaluation of sterile and non-sterile medical devices that come into direct or indirect contact with the human body. This document specifically covers the use of ISO 10993-1 but also...
NEW MDSAP DOCUMENT: mdsap audit approach.
The intention of the Medical Device Single Audit Program (MDSAP) is to allow competent auditors from MDSAP recognized Auditing Organizations (AOs) to conduct a single audit of a medical device organization’s quality management system that will satisfy the requirements...
The European Commission has published a frequently asked questions document (FAQs) on UDI System
The European Commission has published a frequently asked questions document (FAQs) on UDI System The existing regulatory framework on medical devices dates back to the 1990s and consists of three Directives. Two new Regulations (Regulation (EU) 745/2017 on...
COSMETIC BORDELINE MANUAL. SEPT 2020
MANUAL OF THE WORKING GROUP ON COSMETIC PRODUCTS (SUB-GROUP ON BORDERLINE PRODUCTS) ON THE SCOPE OF APPLICATION OF THE COSMETICS REGULATION (EC) NO 1223/2009 (ART. 2(1)(A)) VERSION 5.2 (SEPTEMBER 2020) The clear determination of the scope of application of...
EC: Updated version 18 of Q&A on safety features for medicinal products for human use
On August 12, 2020, the European Commission published version 18 of the Q&A on safety characteristics for medicinal products. The document, which has now grown to 34 pages, was thus the second update this year New are the questions 4.6, 5.12, 5.13 and 6.9, which...
Good reliance practices in regulatory decision-making for medical products: high-level principles and considerations
The World Health Organization (WHO) supports the implementation of reliance on other regulators’ work as a general principle in order to make the best use of available resources and expertise. This principle enables leveraging the output of others whenever possible...
CONTRATAÇÃO PÚBLICA – GUIA PRÁTICO PARA PROFISSIONAIS
O presente guia destina-se essencialmente aos profissionais que, lidando com contratos públicos no seio de autoridades adjudicantes na União Europeia, são responsáveis por planear e levar a cabo uma aquisição conforme, eficiente e com uma boa relação qualidade/preço...
EMA new guideline on the Quality of Water for Pharmaceutical Use
The European Medicines Agency issued a new guideline on the quality of water for pharmaceutical use that will replace its nearly two-decades-old guidance and position statement on water quality when it takes effect in February 2021 This document is...
Launch of public consultation on joint network strategy to 2025
EMA and the Heads of Medicines Agencies (HMA) have developed a joint strategy for the next five years that is released for a two-month public consultation today. The draft strategy details how the European medicines agencies’ network can continue to enable the supply...
FDA New Guidance on Multiple Function Device Products
Medical products may contain several functions, some of which are subject to FDA’s regulatory oversight as medical devices, while others are not. Section 3060(a) of the 21st Century CuresAct (Cures Act) amended the Federal Food Drug, and Cosmetic Act (FD&C Act) to...
Novos pedidos de AIM: Uma formação muito útil e com excelentes exercícios práticos
Decorreu nos dias 22 e 23 de julho de 2020, a 1ª edição da formação sobre os Novos pedidos de AIM , conduzida pelo especialista Dr Selmo Pinto,MRP/DCP Process Manager,do INFARMED Uma combinação de teoria e exercícios práticos, para adquirir os conhecimentos ...
Formação sobre Promo review Compliance & Best practices 2020: Mais uma edição marcada pelo sucesso
Teve lugar no dia 21 de Julho 3ª edição da formação exclusiva da Formiventos sobre PROMOTIONAL REVIEW COMPLIANCE & BEST PRACTICES conduzida pelo especialista DR Ricardo Andrade, Managing Director , da OWL PHARMA CONSULTING, bajo o lema “Como conseguir a...